Matura z chemii 2012 - poziom podstawowy
rozwiązania ze szczegółowym opracowaniem - ciąg dalszy
Zobacz też: matura z chemii 2012 - poziom rozszerzony część 1 - część 2 - część 3
Informacja do zadań 13. i 14.
Poniższy wykres przedstawia zależność rozpuszczalności bezwodnego siarczanu(VI) sodu w wodzie od temperatury. Punkt A wykresu odpowiada temperaturze równej 32,4 stopni C i rozpuszczalności równej 49,7 g w 100 g wody.
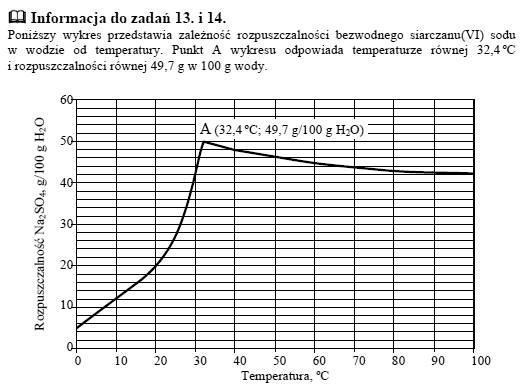
Zadanie 13.
W 100 g wody rozpuszczono taką ilość bezwodnego siarczanu(VI) sodu, że otrzymano roztwór nasycony o temperaturze 10 stopni C. Następnie do naczynia z roztworem dosypano jeszcze porcję 8 g tej soli, która nie uległa rozpuszczeniu.
Oszacuj najniższą temperaturę, do której należałoby ogrzać roztwór, aby dodana porcja soli całkowicie się rozpuściła.
Rozwiązanie
Zadanie 14.
Dokończ poniższe zdania, wpisując odpowiednie wartości temperatury.
[Odczytujemy z wykresu]
1. Rozpuszczalność Na2SO4 w temperaturze 100 stopni C jest taka sama, jak w temperaturze 30 stopni C.
2. Najmniejszą rozpuszczalność Na2SO4 osiąga w temperaturze 0 stopni C.
3. Największą rozpuszczalność Na2SO4 osiąga w temperaturze 32,4 stopni C.
4. Ochładzanie nasyconego w temperaturze 100 stopni C roztworu Na2SO4 aż do temperatury 30 stopni C nie powoduje wykrystalizowania części rozpuszczonej soli.
Zadanie 15.
Rozpuszczalność amoniaku w wodzie w temperaturze 20 stopni C i pod ciśnieniem atmosferycznym wynosi 52 g w 100 g wody.
Oblicz stężenie procentowe nasyconego wodnego roztworu amoniaku w temperaturze 20 stopni C i pod ciśnieniem atmosferycznym. Wynik podaj z dokładnością do pierwszego miejsca po przecinku.
Obliczenia:
Cp = (ms / mr) * 100%
Cp = [(52g)/(100g + 52g)] * 100%
Cp = 34,2%
Odpowiedź: Stężenie procentowe nasyconego wodnego roztworu amoniaku w temperaturze 20 stopni C i pod ciśnieniem atmosferycznym wynosi około 34,2%.
Zadanie 16.
Do wody destylowanej wprowadzono chlorek baru i chlorek miedzi(II), otrzymując roztwór.
a) Korzystając z tablicy rozpuszczalności, wybierz spośród wymienionych poniżej odczynnik, którego dodanie do otrzymanego roztworu spowoduje usunięcie jonów miedzi(II) przez wytrącenie trudno rozpuszczalnego związku, a nie spowoduje usunięcia jonów baru. Uzasadnij odpowiedź, pisząc w formie jonowej skróconej równanie reakcji, która zajdzie po dodaniu do roztworu wybranego odczynnika.
Wybrany odczynnik (podkreśl): Na2SO4 (aq) NaNO3 (aq) (NH4)3PO4 (aq) (NH4)2S (aq)
[Podkreślony został siarczek amonu, ponieważ CuS jest praktycznie nierozpuszczalny w wodzie i wytrąci się, a BaS jest dobrze rozpuszczalny i nie wytrąci się.]
Równanie reakcji: Cu2+ + S2- → CuS↓
b) Podaj nazwę metody, którą należy zastosować, aby otrzymany osad oddzielić od roztworu.
Odpowiedź: filtracja [Inaczej: sączenie. Osad można też oddzielić od roztworu przez sedymentację i dekantację, jednak prawdopodobnie twórcom matury "nie chodziło" o taką odpowiedź.]
Zadanie 17.
Uzupełnij poniższe zdania, podkreślając jedno określenie z trzech podanych w każdym nawiasie.
Roztwór o odczynie obojętnym ma pH ( mniejsze od / równe / większe od ) 7, a roztwór o odczynie zasadowym ma pH ( mniejsze od / równe / większe od ) 7.
[Nie wymaga wyjaśnienia - wiemy albo nie wiemy]
Zadanie 18.
Tlenek srebra(I) w zetknięciu z roztworem nadtlenku wodoru reaguje zgodnie ze schematem:
Ag2O + H2O2 → Ag + O2 + H2O
a) Dobierz i uzupełnij współczynniki stechiometryczne w podanym wyżej schemacie reakcji, stosując metodę bilansu elektronowego.
Bilans elektronowy: 2AgI + 2e → 2Ag0 2O-I → O20 + 2e
Równanie reakcji:
Ag2O + H2O2 → 2Ag + O2 + H2O
b) Określ funkcję, jaką w tej reakcji pełni nadtlenek wodoru.
Nadtlenek wodoru pełni w tej reakcji funkcję reduktora
[Tlen z nadtlenku wodoru zwiększa swój stopień utlenienia, zatem nadtlenek wodoru jest reduktorem. Można to też wywnioskować z tego, że srebro zmniejsza swój stopień utlenienia, zatem tlenek srebra jest utleniaczem, w takim razie nadtlenek wodoru jest reduktorem. Alternatywnie - z tego, że tlen z nadtlenku wodoru oddaje elektrony.]
Zadanie 19.
Reakcja miedzi z rozcieńczonym kwasem azotowym(V) przebiega zgodnie z równaniem:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
W nadmiarze rozcieńczonego kwasu azotowego(V) uległo roztworzeniu 16 g miedzi.
Oblicz masę Cu(NO3)2 otrzymanego w wyniku opisanej reakcji. Wynik podaj z dokładnością do liczb całkowitych. Użyj następujących wartości mas molowych: MH = 1 g*mol-1, MN = 14 g*mol-1, MO = 16 g*mol-1, MCu = 64 g*mol-1.
Obliczenia:
MCu = (64 + 2*14 + 6*16) g*mol-1 = 188 g*mol-1 16g Cu ------ x[g] Cu(NO3)2 3 * 64g Cu ------ 3 * 188g Cu(NO3)2
[Pierwsza linijka proporcji wynika z treści zadania, druga z równania reakcji.]
3 * 64g * x = 16g * 3 * 188g 192x = 9024g x = 47g
Odpowiedź: W reakcji otrzymano 47 gramów Cu(NO3)2.
Zadanie 20.
Dysproporcjonowanie to reakcja utleniania i redukcji, w której część atomów tego samego pierwiastka na pośrednim stopniu utlenienia ulega redukcji, działając jako utleniacz, a część utlenia się, będąc reduktorem. Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007
Spośród podanych niżej równań reakcji utleniania i redukcji wybierz to, które jest równaniem procesu dysproporcjonowania. Wybrane równanie podkreśl.
A. Ag + 2HNO3 → AgNO3 + NO2 + H2O B. (NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O C. 2NO2 + H2O → HNO3 + HNO2 D. 3S + 4HNO3 → 3SO2 + 4NO + 2H2O
[Równanie C ilustruje reakcję dysproporcjonowania, ponieważ część atomów azotu przechodzi z 4 stopnia utlenienia na 5, część przechodzi z 4 na 3.]
Zadanie 21.
Spośród przedstawionych poniżej wzorów wybierz wszystkie, które ilustrują budowę cząsteczek węglowodorów nienasyconych.

Budowę cząsteczek węglowodorów nienasyconych ilustrują wzory III, IV i VI.
[Węglowodory to związki węgla z wodorem (nie zawierają atomów żadnych innych pierwiastków). Związki nienasycone, to takie, w których występuje przynajmniej jedno wiązanie wielokrotne (podwójne lub potrójne) pomiędzy atomami węgla.]
Zadanie 22.
Napisz wzory półstrukturalne (grupowe) i nazwy systematyczne dwóch izomerycznych węglowodorów, które należą do szeregu homologicznego etynu, a ich cząsteczki zawierają 4 atomy węgla.
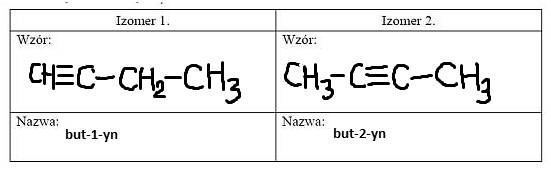
Zadanie 23.
a) Przeanalizuj poniższe schematy przedstawiające trzy reakcje chemiczne, którym ulegają węglowodory, i wpisz wzory brakujących substratów lub produktów oraz uzupełnij współczynniki stechiometryczne. Związki organiczne przedstaw za pomocą wzorów półstrukturalnych (grupowych).
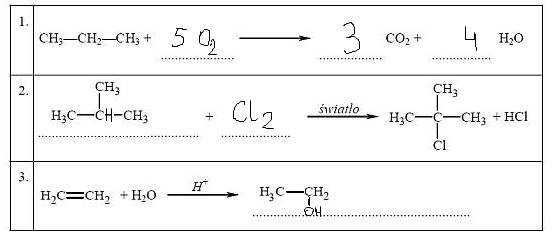
b) Uzupełnij poniższe zdanie.
Reakcja addycji to reakcja, której schemat oznaczono numerem 3, a reakcja substytucji to reakcja, której schemat oznaczono numerem 2.
