Matura z chemii 2012 - poziom rozszerzony
rozwiązania ze szczegółowym opracowaniem - ciąg dalszy 2
Zadanie 17.
Badano szybkość trzech reakcji chemicznych zachodzących zgodnie z równaniami:
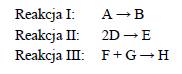
I - pierwszy [Ponieważ szybkość reakcji rośnie liniowo.] III - zerowy [Ponieważ szybkość reakcji nie zależy od stężenia substratów.]
Na wykresach przedstawiono zależność szybkości tych reakcji od stężeń molowych ich substratów oznaczonych symbolami A, D i F.
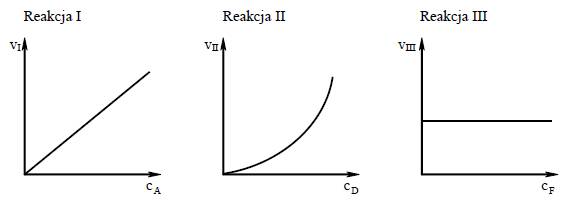
vI, vII, vIII - szybkości reakcji I, II i III cA , cD , cF - stężenia molowe substratów A, D i F
Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
a) Przeanalizuj powyższe wykresy i uzupełnij tabelę, określając rząd reakcji I ze względu na substrat A oraz rząd reakcji III ze względu na substrat F.

b) Dokończ poniższy zapis, tak aby otrzymać równanie kinetyczne reakcji II.
vII = k * CD2
Informacja do zadań 18.-20. Bufory pH to roztwory zawierające sprzężoną parę kwas-zasada Brönsteda w podobnych stężeniach. Roztwory te mają zdolność do utrzymywania stałej wartości pH po dodaniu do nich niewielkich ilości mocnych kwasów lub zasad. Działanie buforu pH polega na tym, że po dodaniu mocnego kwasu zasada Brönsteda reaguje z jonami H3O+, a po dodaniu mocnej zasady kwas Brönsteda reaguje z jonami OH-. Przykładem roztworu buforowego jest bufor amonowy, który otrzymuje się przez rozpuszczenie w wodzie amoniaku NH3 i chlorku amonu NH4Cl. Sprzężoną parę kwas-zasada stanowią obecne w nim kationy amonowe i cząsteczki amoniaku.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, t. 1, Warszawa 2005
Zadanie 18.
Napisz w formie jonowej skróconej równania reakcji, które zachodzą w buforze amonowym po dodaniu mocnego kwasu (reakcja I) i mocnej zasady (reakcja II).
I NH3 + H3O+ → NH4+ + H2O II NH4+ + OH- → NH3 + H2O
Zadanie 19.
W buforze amonowym reakcja cząsteczek amoniaku z cząsteczkami wody zachodzi w stopniu, który można pominąć. Przyczyną cofnięcia tej reakcji jest obecność kationów amonowych wprowadzonych do roztworu przez rozpuszczenie chlorku amonu, który jest całkowicie zdysocjowany.
Oceń prawdziwość poniższych zdań. Wpisz do tabeli literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeśli jest fałszywe.

Zdanie 1 jest prawdziwe. Praktycznie wszystkie jony amonowe pochodzą z dysocjacji (całkowitej) chlorku amonu, reakcja amoniaku z wodą zachodzi w stopniu, który można pominąć.
Zdanie 2 jest nieprawdziwe. Reakcja amoniaku z wodą zachodzi w stopniu, który można pominąć.
Zdanie 3 jest prawdziwe. Reakcja amoniaku z wodą zachodzi w stopniu, który można pominąć.
Zadanie 20.
O pH roztworu buforowego decyduje rodzaj zawartej w nim sprzężonej pary kwas-zasada oraz stosunek stężenia kwasu i sprzężonej z nim zasady.
Oceń, jak wpłynie na pH buforu amonowego rozcieńczenie go wodą destylowaną. Uzupełnij poniższe zdanie, wpisując określenie wzrośnie, zmaleje lub nie zmieni się.
Po rozcieńczeniu buforu amonowego jego pH nie zmieni się. [Ponieważ nie zmieni się stosunek stężenia kwasu i sprzężonej z nim zasady.]
Zadanie 21.
Do wodnego roztworu chromianu(VI) potasu dodano kilka kropli rozcieńczonego kwasu siarkowego(VI) i stwierdzono, że roztwór zmienił barwę z żółtej na pomarańczową. Świadczyło to o powstaniu anionów dichromianowych(VI) (reakcja I). Następnie do otrzymanego roztworu wprowadzono kilka kropli roztworu wodorotlenku potasu i roztwór z powrotem stał się żółty (reakcja II).
a) Napisz w formie jonowej skróconej równania reakcji I i II.
I 2 CrO42- + 2 H+ → Cr2O72- + H2O II Cr2O72- + 2 OH- → 2 CrO42- + H2O
b) Spośród poniższych zdań wybierz wszystkie, które są wnioskami wynikającymi z opisanego doświadczenia.
I Chromiany(VI) są silnymi utleniaczami, a ich właściwości utleniające zależą od pH środowiska reakcji. [To zdanie nie jest wnioskiem z doświadczenia, nie ma w nim utleniania ani reducji.]
II Przemiana anionów chromianowych(VI) w aniony dichromianowe(VI) jest reakcją odwracalną. [Zdanie jest prawdziwe i jest wnioskiem z doświadczenia.]
III W środowisku zasadowym trwałe są aniony chromianowe(VI), a w środowisku kwasowym - aniony dichromianowe(VI). [Zdanie jest prawdziwe i jest wnioskiem z doświadczenia.]
IV W środowisku zasadowym trwałe są aniony dichromianowe(VI), a w środowisku kwasowym - aniony chromianowe(VI). [Zdanie jest nieprawdziwe.]
Numery wybranych zdań: II i III.
Zadanie 22.
W 1 dm3 wody rozpuszczono azotan(V) srebra(I) AgNO3, azotan(V) miedzi(II) Cu(NO3)2 oraz azotan(V) sodu NaNO3, otrzymując roztwór o jednakowych stężeniach molowych kationów. Przez otrzymany roztwór przepuszczono ładunek elektryczny w warunkach umożliwiających wydzielenie na katodzie kolejno trzech pierwiastków.
I - srebro II - miedź III - sód
b) Wiedząc, że w doświadczeniu użyto elektrod grafitowych, określ, jaki pierwiastek wydzielił się na anodzie. Odpowiedź uzasadnij, pisząc równanie reakcji anodowej.
Nazwa lub symbol pierwiastka: tlen. [Podczas elektrolizy wodnych roztworów soli kwasów tlenowych na anodzie wydziela się tlen.]
Równanie reakcji: 2 H2O → 4 H+ + O2 + 4 e
a) Uzupełnij poniższą tabelę, wpisując nazwy lub symbole pierwiastków w kolejności ich wydzielania na katodzie.

I - srebro [Metal szlachetny, najmniej aktywny spośród Ag, Cu i Na.]
II - miedź [Metal mało aktywny, lecz bardziej aktywny od srebra.]
III - sód [Metal aktywny.]
Zadanie 23.
Zaprojektuj ogniwo galwaniczne, w którym półogniwo Ni|Ni2+ będzie pełnić funkcję anody.
a) Uzupełnij poniższy schemat, wpisując symbole lub wzory odczynników wybranych spośród następujących:
Ni Ni(NO3)2 (aq) Pb Pb(NO3)2 (aq) Zn Zn(NO3)2 (aq)
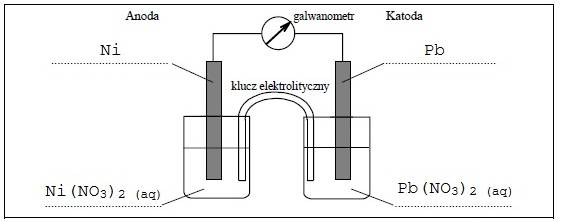
b) Opisz zmiany, jakie będzie można zaobserwować w półogniwach podczas pracy ogniwa.
Anoda: Anody będzie ubywać (będzie się roztwarzać).
Katoda: Na katodzie będzie wydzielał się szaro-połyskujący osad.
Zadanie 24.
W reakcji z wodnym roztworem manganianu(VII) potasu eten utlenia się do etano-1,2-diolu (glikolu etylenowego).
Wyznacz stopnie utlenienia atomów węgla w cząsteczce etenu i cząsteczce etano-1,2-diolu oraz określ liczbę moli elektronów oddawanych przez 1 mol etenu w opisanej reakcji.
Stopnie utlenienia atomów węgla w cząsteczce etenu: -2 i -2
Stopnie utlenienia atomów węgla w cząsteczce etano-1,2-diolu: -1 i -1
Liczba moli elektronów: 2
Zadanie 25.
Na przykładzie reakcji chloru z etanem i chloru z benzenem porównaj mechanizm reakcji substytucji, którym ulegają węglowodory nasycone i aromatyczne. Uzupełnij poniższe zdania, wybierając nazwy spośród podanych w nawiasach (wybrane nazwy podkreśl).
1. Etan ulega reakcji substytucji ( elektrofilowej / nukleofilowej / wolnorodnikowej ). Drobiny, które reagują bezpośrednio z cząsteczkami etanu, to ( atomy chloru Cl. / cząsteczki chloru Cl2 / aniony chlorkowe Cl- ). Są one ( rodnikami / elektrofilami / nukleofilami ), które powstają z cząsteczek chloru pod wpływem ( światła / FeCl3 jako katalizatora / rozpuszczalnika ).
2. Benzen ulega reakcji substytucji ( elektrofilowej / nukleofilowej / wolnorodnikowej ). Drobiny, które reagują bezpośrednio z cząsteczkami benzenu, są ( rodnikami / elektrofilami / nukleofilami ). Powstają one z cząsteczek chloru pod wpływem ( światła / FeCl3 jako katalizatora / rozpuszczalnika ).
Zadanie 26.
Odczynnik Tollensa, potocznie nazywany amoniakalnym roztworem tlenku srebra, otrzymuje się przez dodanie wody amoniakalnej do wodnego roztworu AgNO3. Potoczna nazwa odczynnika nie jest poprawna, ponieważ jon O2- nie występuje w roztworach wodnych.Początkowo wytrąca się czarnobrunatny osad tlenku srebra(I). W miarę dodawania kolejnych porcji wody amoniakalnej osad ten ulega roztworzeniu, ponieważ jony srebra(I) tworzą z cząsteczkami amoniaku jony kompleksowe o wzorze Ag(NH3)2+ . W wyniku tej reakcji powstaje bezbarwny roztwór, który jest odczynnikiem Tollensa.
a) Uzupełnij poniższe zapisy, tak aby otrzymać równania (w formie jonowej) opisanych reakcji. Wpisz wzory produktów oraz brakujące współczynniki stechiometryczne.
Równanie reakcji powstawania tlenku srebra(I):
2 Ag+ + 2 OH- → Ag2O + H2O
Równanie reakcji tlenku srebra(I) z amoniakiem:
Ag2O + 4 NH3 + H2O → 2 Ag(NH3)2+ + 2 OH-
b) Określ odczyn roztworu będącego odczynnikiem Tollensa.
Zasadowy. [Ponieważ powstają jony OH-.]
Zadanie 27.
W roztworze o odczynie zasadowym ketony, których cząsteczki zawierają grupę hydroksylową -OH przy atomie węgla połączonym z atomem węgla grupy karbonylowej (alfa-hydroksyketony), ulegają izomeryzacji. Przemianę tę ilustruje poniższy schemat.
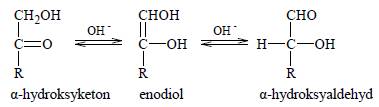
Oceń, czy za pomocą próby Tollensa można odróżnić glukozę od fruktozy. Odpowiedź uzasadnij.
Glukozy nie można odróżnić od fruktozy za pomocą próby Tollensa, ponieważ oba te cukry posiadają właściwości redukujące. [Wszystkie cukry proste posiadają właściwości reduujące.]
Zadanie 28.
Poniżej przedstawiono wzory (w projekcji Hawortha) ilustrujące budowę wybranych mono- i disacharydów.
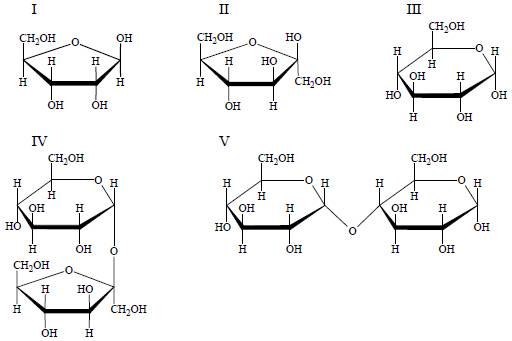
Wskaż wszystkie sacharydy, które dają pozytywny wynik próby Tollensa.
[I, II i III to cukry proste, więc na pewno mają właściwości redukujące. IV i V to dwucukry. Właściwości redukujące mają te dwucukry, w których występuje wolna jednostka hemiacetalowa. Wolna jednostka hemiacetalowa występuje w cukrze V, a nie występuje w cukrze IV.]
Numery wzorów wybranych sacharydów: I, II, III i V
Zadanie 29.
Reakcja glukozy z odczynnikiem Tollensa przebiega zgodnie z poniższym schematem:
CH2OH-(CHOH)4-CHO + Ag(NH3)2+ + OH- → → CH2OH-(CHOH)4-COO- + Ag + NH3 + H2O
a) Napisz w formie jonowej z uwzględnieniem pobranych lub oddanych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania.
Równanie procesu redukcji: Ag(NH3)2+ + e → Ag + 2 NH3 /*2
Równanie procesu utleniania: CH2OH-(CHOH)4-CHO + 3 OH- → → CH2OH-(CHOH)4-COO- + 2 H2O + 2 e
b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
CH2OH-(CHOH)4-CHO + 2 Ag(NH3)2+ + 3 OH- → → CH2OH-(CHOH)4-COO- + 2 Ag + 4 NH3 + 2 H2O
Zadanie 30.
Pewien alkan o rozgałęzionym łańcuchu węglowym poddano chlorowaniu, otrzymując dwie izomeryczne monochloropochodne o masie molowej M = 92,5 g*mol-1.
a) Napisz wzór sumaryczny alkanu poddanego chlorowaniu.
[Wzór ogólny monochloropochodnej alkanu: CnH2n+1Cl. Zatem: n * 12 g/mol + (2n + 1) * 1 g/mol + 35,5 g/mol = 92,5 g/mol 14n = 56 n = 4.]
C4H9Cl
b) Napisz wzory półstrukturalne (grupowe) obu otrzymanych monochloropochodnych tego alkanu oraz podaj ich nazwy systematyczne.
[Jest tylko jeden możliwy rozgałęziony łańcuch węglowy zawierający 4 atomy węgla i nie zawierający wiązań wielokrotnych.] Wzór 1:
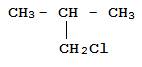
Nazwa 1:
1-chloro-2-metylopropan
[Nazwa byłaby bardziej oczywista, gdyby zamienić miejscami grupę -CH2Cl z którąkolwiek grupą -CH3 (byłby to nadal ten sam związek).]
Wzór 2:

Nazwa 2:
2-chloro-2-metylopropan